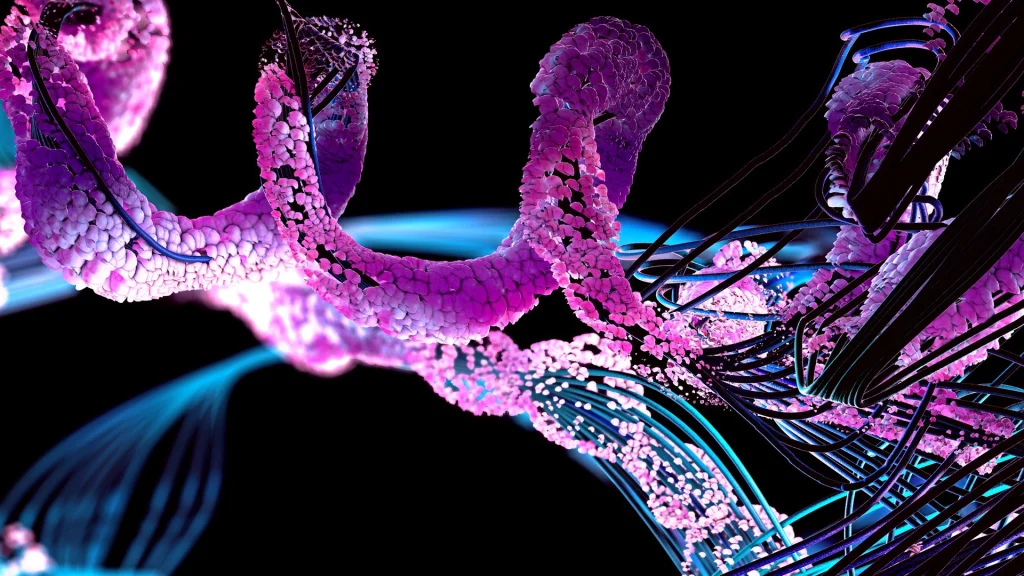
Resultatet baner vejen for en større forståelse af kroppens mindste byggesten og bedre behandling af sygdomme som kræft Alzheimers og Parkinson.
Lige nu læser andre
Tæt på 100.000 ældre danskere og over 55 millioner mennesker globalt oplever dagligt udfordringer forbundet med demenssygdomme som Alzheimers eller Parkinsons.
Disse lidelser skyldes sammenklumpning af mikroskopiske byggeklodser i kroppen, som forstyrrer vitale funktioner.
Den præcise årsag til denne sammenklumpning og effektive behandlingsmetoder forbliver et mysterium inden for videnskaben. Tidligere har undersøgelse af dette fænomen været begrænset af manglen på passende værktøjer.
Imidlertid har forskere fra Hatzakis-laboratoriet ved Kemisk Institut på Københavns Universitet udviklet en machine learning-algoritme, der muliggør realtidsobservation af sammenklumpningen under mikroskopet.
Læs også
Denne algoritme kan automatisk identificere og følge vigtige karakteristika af de klumpede byggeklodser, der er ansvarlige for sygdomme som Alzheimer.
Dette gennembrud repræsenterer en betydelig fremskridt, da det tidligere har været en udfordring at undersøge disse proteinklumper i dybden på grund af teknologiske begrænsninger.
“Vores algoritme løser på få minutter en opgave, der tidligere ville have krævet flere ugers arbejde fra en forsker. Denne automatisering af analyseprocessen af mikroskopibilleder af proteinklumper kan forhåbentlig resultere i øget forståelse og flere behandlingsmuligheder for sygdomme, der angriber hjernen,” siger Ph.d. Jacob Kæstel-Hansen fra Kemisk Institut.
Resultaterne af forskningen er blevet publiceret i det anerkendte videnskabelige tidsskrift Nature Communications.
Opdagelse af mikroskopiske proteiner på rekordtid
I kroppens naturlige processer forekommer en kontinuerlig udveksling af stoffer og signaler mellem proteiner og andre molekyler i vores celler.
Fejl i denne proces kan føre til dannelse af proteinklumper, der forstyrrer cellernes funktion og kan resultere i sygdomme såsom neurodegenerative lidelser og kræft.
Den udviklede machine learning-algoritme kan identificere disse proteinklumper ned til en milliardtedel meter i mikroskopibilleder.
Algoritmen er også i stand til at kvantificere og kategorisere klumperne baseret på deres form og størrelse samt følge deres udvikling over tid.
Denne detaljerede analyse er afgørende, da formen af proteinklumperne kan have betydning for deres funktion og deres virkning i kroppen.
“Ved at undersøge disse klumper gennem et mikroskop kan vi hurtigt observere variationer i deres form og struktur. Manuelt at tælle og analysere disse klumper kræver imidlertid meget tid, som nu kan frigøres til mere produktive formål,” forklarer Steen Bender fra Kemisk Institut.
Den nye algoritme vil effektivisere forskningen inden for proteinklumper og deres rolle i sygdomsudvikling og potentielt føre til udviklingen af nye behandlingsmetoder.
“En dybere forståelse af disse proteinklumper er afgørende for udviklingen af effektive behandlingsmetoder. Denne algoritme giver os mulighed for at studere proteinklumper på en måde, der tidligere var umulig,” tilføjer Jacob Kæstel-Hansen.
Udvikling af ny medicin
Forskere ved Kemisk Institut arbejder på at anvende algoritmen til at studere insulinmolekyler, der også er tilbøjelige til at danne klumper og dermed miste deres evne til at regulere blodsukkerniveauer.
“Vi observerer også uhensigtsmæssig sammenklumpning af insulinmolekyler. Denne algoritme kan hjælpe os med at forstå, hvordan forskellige stoffer påvirker disse klumper, hvilket kan åbne døren for udviklingen af nye behandlingsformer,” forklarer Jacob Kæstel-Hansen.
Forskere ser stort potentiale i anvendelsen af denne algoritme til udvikling af ny medicin og til at forbedre forståelsen af komplekse biologiske processer.
“Vores håb er, at denne forskning kan bidrage til at opbygge et omfattende bibliotek over proteiner og deres strukturer, hvilket vil styrke vores viden om sygdomme og biologiske processer og måske endda åbne døren for nye behandlingsformer,” konkluderer Nikos Hatzakis fra Kemisk Institut.
Algoritmen er offentligt tilgængelig som open source og kan anvendes af forskere og andre interessenter inden for molekylærbiologi og sygdomsbehandling.